
Enfermedad de Alzheimer: una visión de la toxicidad y protección de la proteína TAU
José Luna-Muñoz 1 , Mar Pacheco-Herrero 2 , Koni Mejía–Rojas 3
1. BioBanco Nacional de Demencias. Ciencias Biológicas. Facultad de Estudios Superiores. Cuautitlán campo 1. UNAM. Estado de México. México.
2. Laboratorio de Investigación en Neurociencias. Facultad de Ciencias de la Salud. Pontificia Universidad Católica Madre y Maestra, República Dominicana.
3. Neuróloga del Hospital Nacional Daniel Alcides Carrión, EDMECON Educación Médica Continua, Universidad Nacional Mayor de San Marcos, Lima-Perú
Introducción
La enfermedad de Alzheimer (EA) de etiología y patogénesis inciertas es la causa más común de demencia. La manifestación clínica más esencial y, a menudo más temprana, es el deterioro selectivo de la memoria. El diagnóstico definitivo requiere un examen histopatológico. Macroscópicamente, los encéfalos muestran una reducción considerable en el espesor de la sustancia blanca y gris. Además, presentan surcos prominentes entre las circunvoluciones con una reducción en su tamaño y volumen. En condiciones normales el cerebro tiene un peso de 1.4 a 1.6 kg (Figura 1A, B); sin embargo, en la EA llegar a pesar entre 0. 6 a 0.7 kg. (Figura 1 C, D).
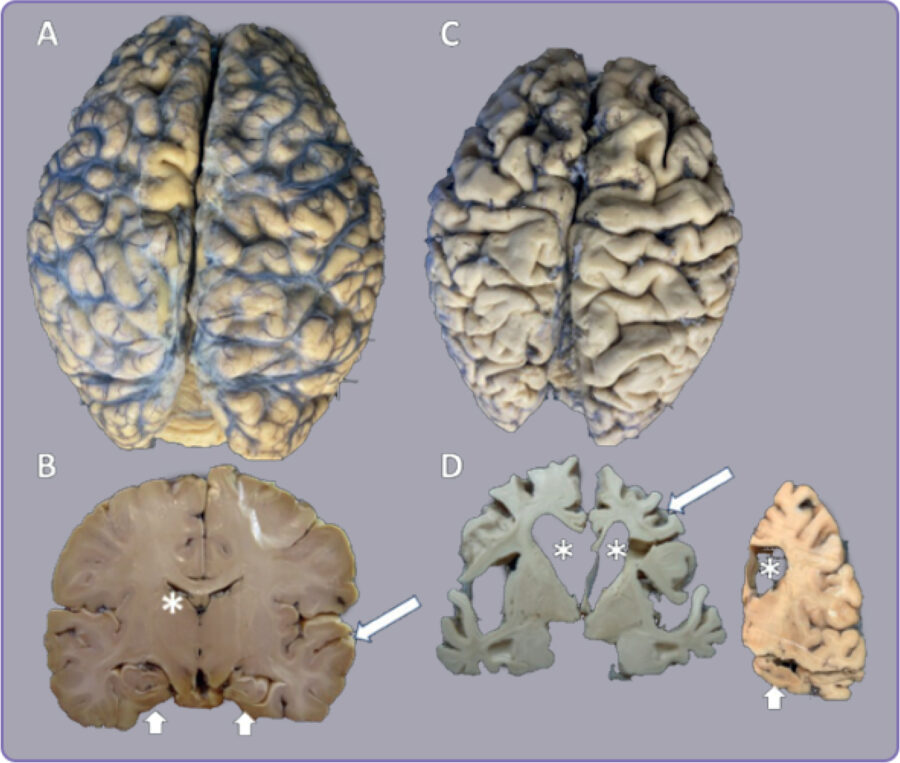
Figura 1. Comparación del un cerebro sin afecciones neurológicas y con la enfermedad de Alzheimer. A y B Cerebro normal. C y D cerebro con la enfermedad de Alzheimer.
Las lesiones histopatológicas que definen a esta enfermedad neurorodegenerativa son las placas neuríticas (PN) y las marañas neurofibrilares (MNF) (Fig. 2 A, B).
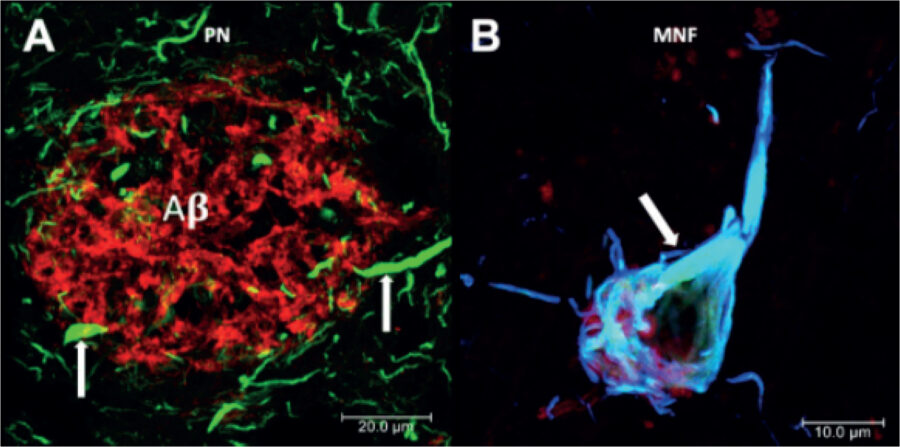
Figura 2. Lesiones histopatológicas características de la enfermedad de Alzheimer.
El concepto preclínico de la enfermedad de Alzheimer
Se define estadío preclínico de la enfermedad a individuos cognitivamente normales que presentan Patología de Alzheimer (PA) en el examen post-mortem. Actualmente se puede identificar in vivo la PA, a través del análisis del líquido cefalorraquídeo (LCR) o del estudio del cerebro con tomografía por emisión de positrones (PET). Los cambios en la proteína tau y la disminución del A 42 en el LCR ocurren hasta 15 y 20 años antes del inicio de los síntomas de la EA, respectivamente. Estos datos fueron corroborados con evidencia post mortem de la presencia de PA en individuos cognitivamente normales. Esta etapa preclínica es importante para los estudios dirigidos a la prevención y búsqueda de nuevos biomarcadores para el diagnóstico y tratamiento de la EA.
Neuropatología de la enfermedad de Alzheimer
Placas Neuríticas
Las placas neuríticas (PNs) (Figura 2A) están constituidas del péptido amiloide-beta (A ). Asociadas a ellas se observan las neuritas distróficas (ND). Estas ND son parte de las dendritas y axones de las células neuronales. El A se origina del procesamiento proteolítico de la proteína precursora de amiloide (PPA). La PPA es una proteína transmembranal que se encuentra en las neuronas y células gliales. La proteólisis de la PPA por las enzimas – y -secretasas liberan un fragmento de 40-42 aminoácidos al espacio extracelular, el cual tiene la capacidad de auto-agregarse y formar las fibrillas insolubles de A . Las PNs favorecen un ambiente inflamatorio prolongado y sostenido, activan a las células microgliales y gliales generando una producción de interleucinas y citocinas, así como un ambiente con grandes cantidades de oxígeno reactivo que afecta a las células neuronales.
Marañas neurofibrilares
Las marañas neurofibrilares (MNF) (Figura 2B) se correlacionan con el deterioro cognitivo del paciente. La presencia de las MNF en el hipocampo sigue un patrón perfectamente definido asociado con las vías de entrada de la información (vía perforante). Las MNF están constituidas por una agregación fibrilar insoluble de la proteína tau. Por su apariencia electrónica, estos filamentos de tau han recibido el nombre de filamentos helicoidales apareados (FHA). La proteína tau en condiciones normales se encuentra en el axón de la neurona, estabilizando los filamentos de tubulina. Por ciclos de fosforilación y defosforilación, la proteína tau cumple su función en el citoesqueleto axonal, favoreciendo el movimiento de vesículas y organelos a lo largo del axón. Sin embargo, en la EA, la proteína tau se disocia del microtúbulo por acción de mecanismos postraduccionales (hiperfosforilación y truncación). Al día de hoy se desconoce los mecanismos que desencadenan estos cambios patológicos postraduccionales.
El procesamiento patológico molecular de la proteína tau
Evolución de la agregación de la proteína tau en el soma neuronal
La agregación patológica de la proteína tau se ha observado en varios pasos, los cuales van desde una agregación granular soluble llamada premarañas-maraña neurofibrilar intracelular (iMNF), hasta la maraña neurofibrilar extracelular (eMNF) que representa la exposición de los FHA expuestos al espacio extracelular (Figura 3).
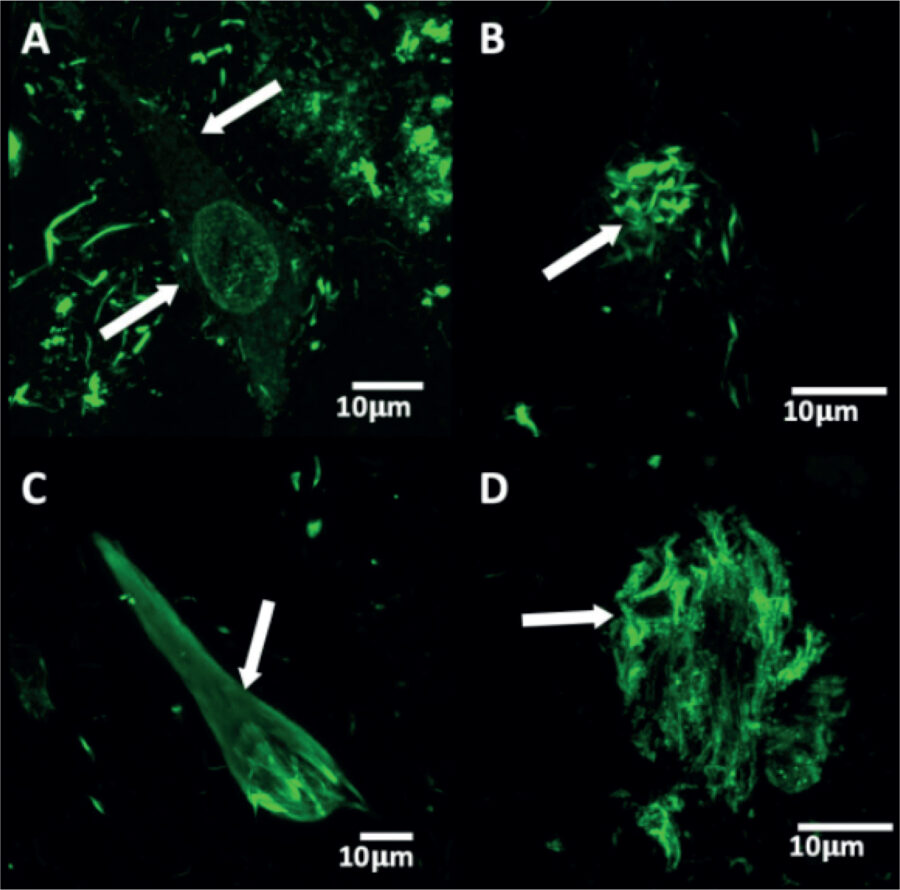
Figura 3. Patrón de agregación de la proteína tau en el soma neuronal.
A) pre maraña neurofibrilar (flechas), B) pequeños agregados densos de la proteína tau, C) Maraña neurofibrilar intracelular, D) Maraña neurofibrilar extracelular.
Procesamiento postraduccional de la proteína tau en la EA
Hiperfosforilación
La proteína tau tiene una escasa estructura secundaria y es blanco de una serie de cinasas y fosfatasas para llevar a cabo su función. Sin embargo, en la EA se observa un desbalance en la actividad de las cinasas y fosfatasas que favorecen la adición de un exceso de grupos fosfatos a lo largo de la molécula de tau. En la EA se han observado 85 sitios probables de fosforilación. Algunos de estos sitios son expresados en condiciones normales y otros solo se han asociado a la EA. En el Biobanco Nacional de Demencias (BND, México) nos hemos enfocado en el estudio de estos mecanismos de fosforilación en las premarañas. Hemos observado que marcadores de fosforilación pueden favorecer los cambios conformacionales regionales, que a su vez favorecen el cambio conformacional estructural. En nuestra primera propuesta de procesamiento hemos descrito una secuencia de eventos dependientes de fosforilación: pT231-TG3-AT8-AT100-Alz-50. Sin embargo, en este procesamiento también se ha observado tempranamente la presencia de fragmentos de la proteína tau (truncación).
Proteólisis de la proteína tau “truncación”
Dentro de los mecanismos postraduccionales de la proteína tau se ha descrito la presencia de la proteína tau truncada. Ambos eventos, hiperfosforilación y truncación, han tratado de describir la génesis de los FHA. Se ha observado que la proteína tau es blanco de varias enzimas que puede romper la molécula en fragmentos. Adicionalmente se ha demostrado que la proteína tau exclusivamente fosforilada impide la polimerización de tau, pero en presencia de la tau truncada ésta puede polimerizar rápidamente.
Truncación As421 de la proteína tau
Esta truncación es llevada a cabo por la caspasa-3 (enzima involucrada en el proceso de muerte celular “Apoptosis”). Puede presentarse desde etapas muy iniciales del procesamiento de la proteína tau, específicamente después de la fosforilación 231 (pT231). Asimismo se ha podido evidenciar que la caspasa-6 puede realizar una proteólisis en el aminoácido 13 de la porción amino -terminal.
Truncación Glu391
Desde 1985, se describió la presencia de la proteína tau truncada en el Glutámico-391, mediante el desarrollo de un marcador específico para esta truncación llamado 423. Este anticuerpo 423 reconoce un fragmento de 92-95 aminoácidos de la región de los dominios repetidos, el cual culmina en el Glu391. Este fragmento es llamado PHF-core y es muy difícil de evidenciarlo debido a que está oculto en una gran cantidad de proteína tau fosforilada. Se ha sugerido que el PHF-core es una entidad patológica que tiene un efecto prion además podría ser el evento iniciador de todo el procesamiento patológico de tau. (Figura 4). Al analizar la presencia de la proteína tau truncada en el Glu-391 en otras enfermedades neurodegenerativas como la enfermedad de Parálisis supranuclear progresiva, tau no tenía afinidad por el marcador 423. Estas observaciones resultan ser muy importantes en la búsqueda de un marcador exclusivo para la EA.
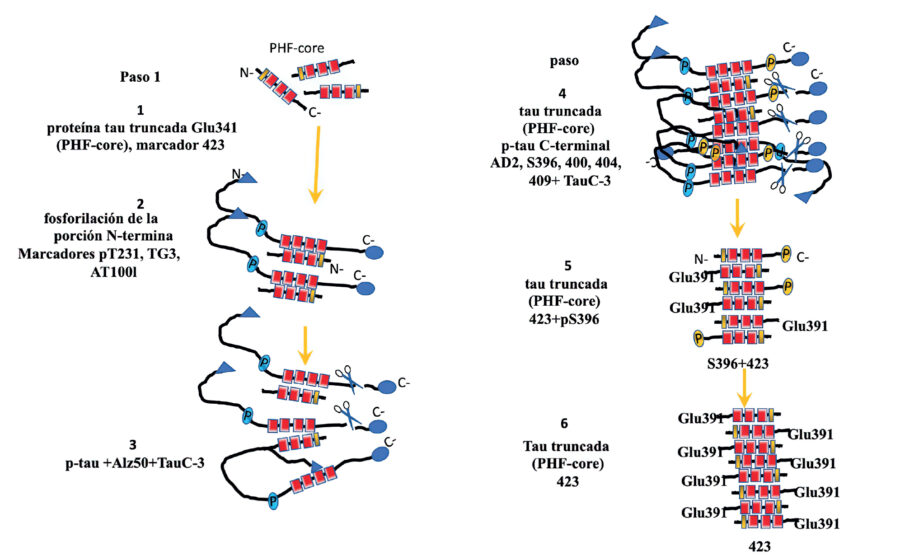
Figura 4. Esquema de la secuencia del procesamiento patológico de la proteína tau en la enfermedad de Alzheimer
Conclusiones
Es muy importante analizar el procesamiento de la proteína tau en las tauopatías y prestar especial atención a la búsqueda de truncaciones en la misma. Esto podría ser la clave para encontrar un marcador exclusivo para la EA y tener un diagnóstico temprano. Hace falta profundizar en el estudio de los mecanismos de proteólisis de la proteína tau, así como buscar otras proteínas que pudiesen estar asociadas a la EA, las cuales podrían llevarnos río arriba para encontrar los mecanismos más tempranos que inducen el desarrollo de los mecanismos patológicos. Para lo cual es de vital importancia realizar los estudios en tejido cerebral humano. La donación de cerebros para investigación y el desarrollo de neurobancos (como el BND) son de vital importancia para encontrar las respuestas que los modelos animales y celulares no pueden darnos.
Bibliografía
Luna-Munoz JH, C. R.; Wischik, C.M.; Flores-Rodríguez, P.; Avila ,J.; Zamudio, S.; De la Cruz, F.; Mena, R.; Meraz-Ríos, M.A. and Floran-Garduño B. (2013) Phosphorylation of Tau Protein Associated as a Protective Mechanism in the Presence of Toxic, C-Terminally Truncated Tau in Alzheimer’s Disease. In: Inga Zerr (ed) Understanding Alzheimer’s Disease. IntechOpen, pp 89-107. doi:10.5772/54228
Martinez-Maldonado A, Ontiveros-Torres MA, Harrington CR, Montiel-Sosa JF, Prandiz RG, Bocanegra-Lopez P, Sorsby-Vargas AM, Bravo-Munoz M, Floran-Garduno B, Villanueva-Fierro I, Perry G, Garces-Ramirez L, de la Cruz F, Martinez-Robles S, Pacheco-Herrero M, Luna-Munoz J (2021) Molecular Processing of Tau Protein in Progressive Supranuclear Palsy: Neuronal and Glial Degeneration. J Alzheimers Dis. doi:10.3233/JAD-201139
Piersson AD, Mohamad M, Rajab F, Suppiah S (2020) Cerebrospinal Fluid Amyloid Beta, Tau Levels, Apolipoprotein, and (1)H-MRS Brain Metabolites in Alzheimer’s Disease: A Systematic Review. Acad Radiol. doi:10.1016/j.acra.2020.06.006
Zetterberg H, Stomrud E (2021) Alzheimer’s disease in primary care: new tools for improved and simplified diagnostics. J Intern Med. doi:10.1111/joim.13249.




Lo sentimos, el formulario de comentarios está cerrado en este momento.