Nuevas opciones de tratamiento en cáncer de próstata: beneficio de enzalutamida en diferentes etapas de la enfermedad
ESMO 2020 European Society for Medical Oncology
Enzalutamida en pacientes con cáncer de próstata sensible a castración metastásico (CPCSm)
La terapia de deprivación androgénica (TDA) es la base del tratamiento del cáncer de próstata avanzado. Es sabido que el agregado de quimioterapia o antiandrógenos de nueva generación impacta de forma significativa en la supervivencia global en los pacientes con enfermedad metastásica resistente a castración1-5. En la actualidad tenemos suficiente evidencia para afirmar que los tratamientos combinados de la TDA + quimioterapia o anti-andrógenos de nueva generación tienen un beneficio significativo en etapas más tempranas de la enfermedad.
En pacientes metastásicos sensibles a castración (CPCSm), el estudio CHAARTED demostró que la utilización de docetaxel + TDA tiene un beneficio en supervivencia global en pacientes con alto volumen de enfermedad. Por otro lado, el estudio LATITUDE demostró el beneficio de abiraterona + TDA en pacientes con CPCSm de alto riesgo.
Estudios más recientes como TITAN y ENZAMET incluyeron a una población más amplia de pacientes (alto y bajo riesgo, alto y bajo volumen) y demostraron que el tratamiento combinado con apalutamida o enzalutamida tiene beneficios significativos en etapas más tempranas de la enfermedad6-7.
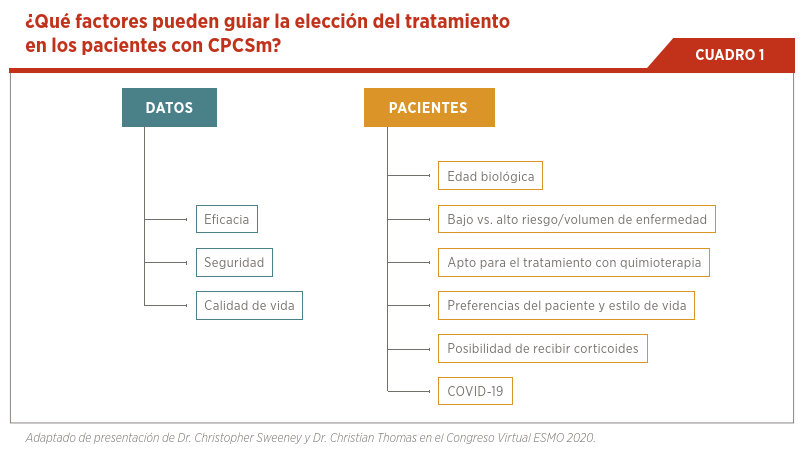
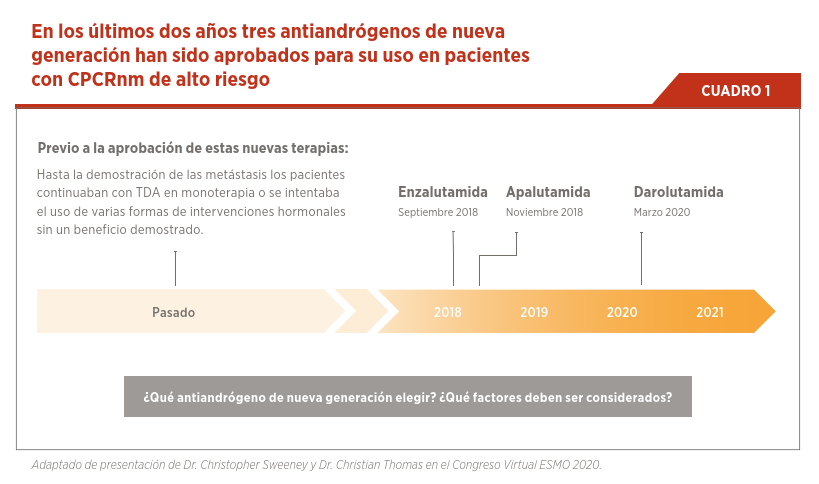
Con todas estas opciones y para poder elegir el mejor tratamiento tenemos que tener en cuenta diferentes factores relacionados con la eficacia, seguridad, calidad de vida y por otro lado, factores relacionados con el paciente como la edad biológica, su condición general, el número y ubicación de las metástasis, las comorbilidades coexistentes y las preferencias del paciente. Hoy se agrega otro factor que es la situación epidemiológica relacionada con el COVID-19, que hace que se prefieran tratamientos ambulatorios y con menor riesgo de generar inmunosupresión (ver Cuadro 1).
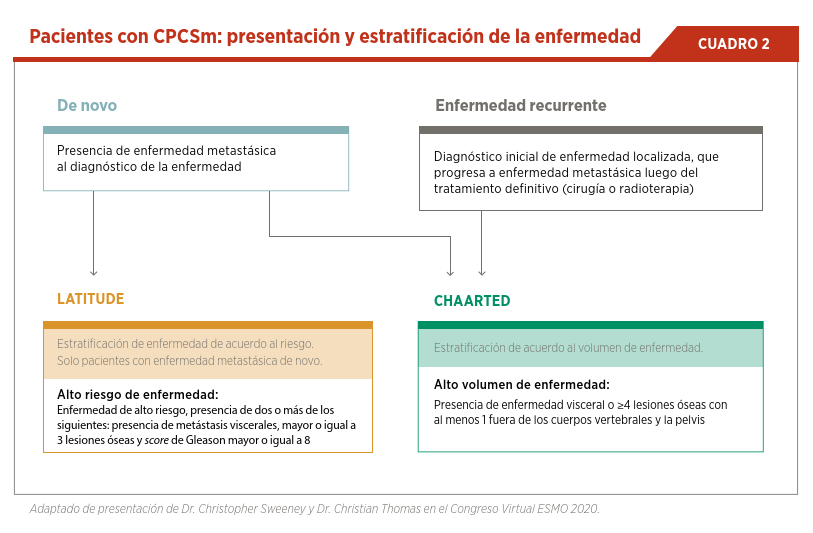
La forma de presentación de la enfermedad, así como la estratificación de los pacientes de acuerdo con el riesgo y carga de enfermedad metastásica son factores importantes que determinan el pronóstico de los pacientes con CPCSm. Tenemos suficiente evidencia para afirmar que los pacientes
que debutan con enfermedad metastásica tienen un peor pronóstico. Este fue un criterio de inclusión en el estudio LATITUDE que demostró el beneficio de la combinación de abiraterona/prednisona + TDA en los pacientes de alto riesgo8. Por el otro lado, los resultados del estudio CHAARTED demuestran que la utilización de docetaxel + TDA tiene un beneficio significativo en supervivencia global en los pacientes con alto volumen de en-fermedad (4 o más lesiones óseas al menos una fuera del esqueleto axial o presencia de lesiones viscerales) (ver Cuadro 2)9.
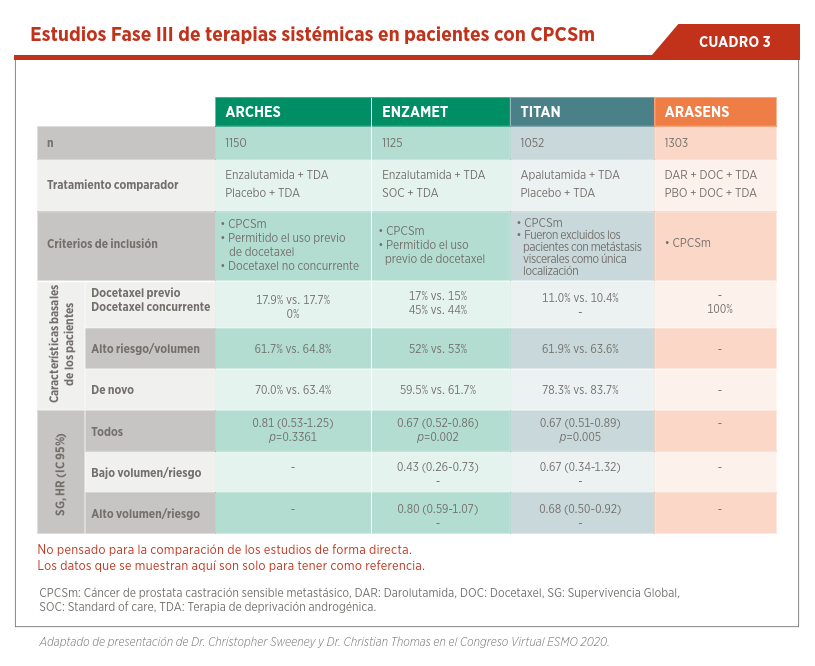
Estudios recientes han demostrado que no solamente los pacientes de alto volumen o riesgo se benefician de la utilización temprana de tratamien-tos combinados. El estudio TITAN demostró que el tratamiento con apalutamida + TDA resulta en un beneficio en supervivencia global y otros objetivos secundarios comparado con la TDA en monoterapia (ver Cuadro 3)6.
Enzalutamida ha demostrado tener un lugar en este subgrupo de pacientes. Inicialmente el estudio ARCHES, demostró que el tratamiento con enzalutamida + TDA en pacientes con CPCSm prolonga el intervalo libre de progresión de forma significativa10. Estos resultados fueron confirmados por el estudio ENZAMET, presentado en sesión plenaria del Congreso de la Sociedad Americana de Oncología (ASCO) en 2019. En este estudio, la combinación de enzalutamida + TDA demostró un beneficio significativo en supervivencia global por sobre los pacientes tratados con TDA + un antiandrógeno clásico. En este estudio fueron incluidos pacientes con riesgo alto y bajo y con alto y bajo volumen de enfermedad, inclusive se permitió la utilización de previa de docetaxel en el contexto de enfermedad sensible a castración. El sub-análisis de los pacientes previamente tratados con docetaxel demuestra que la combinación de quimioterapia con enzalutamida en esta situación de enfermedad no tiene un beneficio significativo hasta el momento (ver Cuadro 4)7. Se encuentra en curso el estudio ARASENS con la utilización de darolutamida, cuyos resultados no fueron publicados al momento11.
En cuanto a qué opción de tratamiento elegir dentro de todas estas alternativas posibles, existe consenso entre los expertos que el tratamiento combinado es la mejor opción en la mayor parte de los pacientes con CPCSm.
Sin llegar a una decisión consensuada de que una opción sea superior al resto en el global de los pacientes, este fue el resultado de la votación en el encuentro de APCCC 201912.
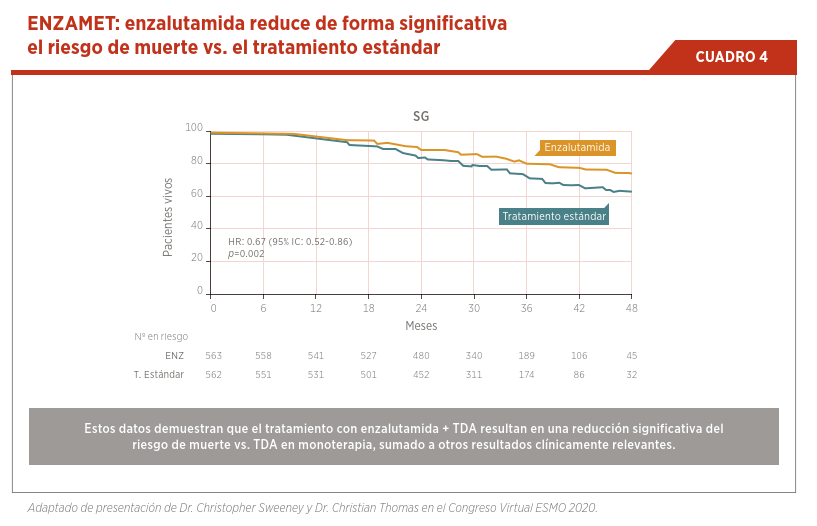
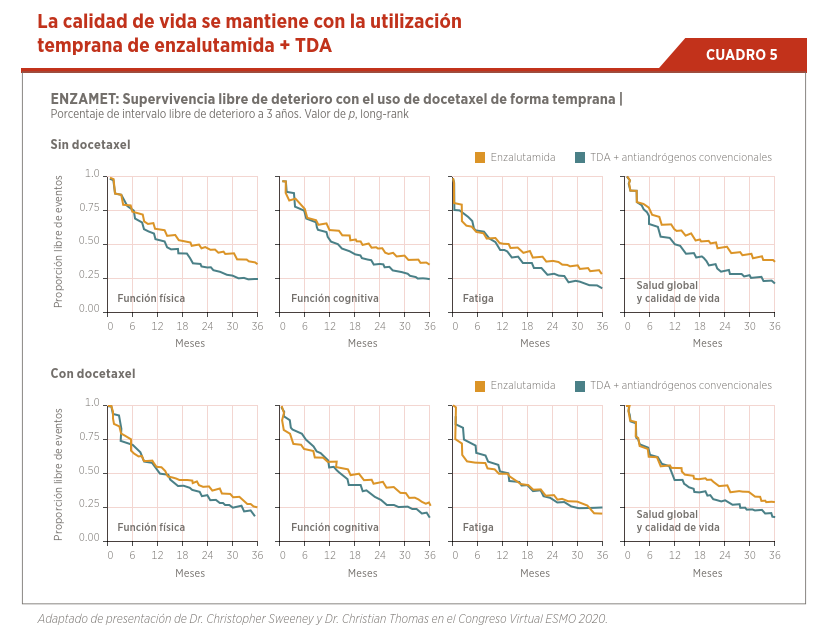
Factores como el perfil de toxicidad de cada uno de los medicamentos y los resultados de calidad de vida son importantes al momento de elegir el tratamiento. Los resultados del estudio ENZAMET demuestran que la intensificación del tratamiento de forma más temprana tiene un beneficio manteniendo la calidad de vida en los pacientes tratados con la combinación (ver Cuadro 5).
Enzalutamida en pacientes con cáncer de próstata resistente a castración no metastásicos (CPCRnm)
Los pacientes con cáncer de próstata resistente a castración no metastásicos son definidos como aquellos que tienen una progresión bioquímica (por PSA) en el contexto de valores de testosterona circulantes en castración (<50 ng/dL) con ausencia de enfermedad metastásica (evaluado por estudios convencionales como tomografía computada y gammagrafía ósea)13. Dentro de este grupo de pacientes, aquellos con un tiempo de duplicación del PSA <10 meses tienen un mayor riesgo de desarrollar metástasis y morir por la enfermedad en un corto período de tiempo. Hasta hace muy poco tiempo no teníamos evidencia de un tratamiento que beneficie a estos pacientes, hasta que nuevos antiandrógenos como apalutamida, darolutamida y enzalutamida demostraron su beneficio en combinación con TDA (ver Cuadro 1).
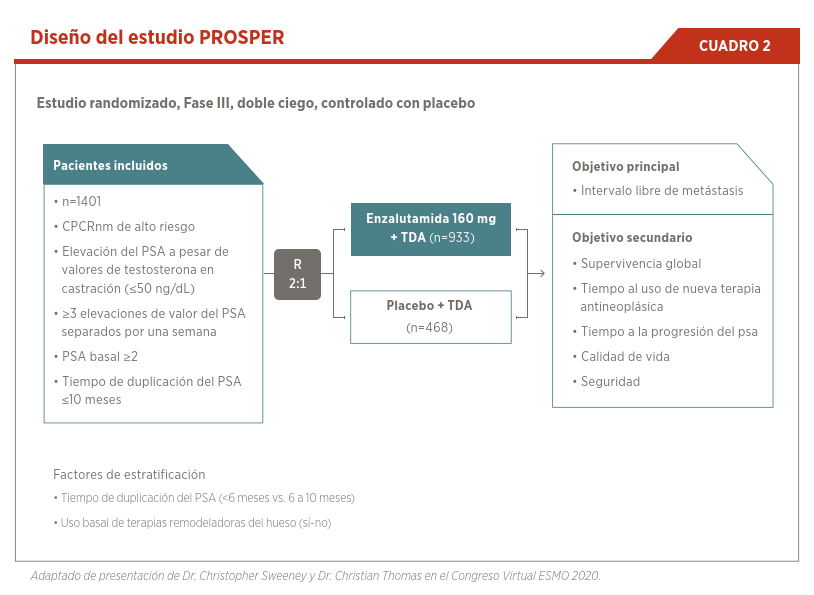
El diseño de los estudios que valieron la aprobación de estas nuevas alternativas fueron similiares. Se incluyeron pacientes con CPCRnm con un tiempo de duplicación del PSA <10 meses, y se estratificaron a continuar con TDA vs. TDA más el antiandrógeno. El objetivo principal fue el intervalo libre de metástasis, la definición de este objetivo varió entre los diferentes estudios, en el estudio ARAMIS14 y SPARTAN15 se definió como el tiempo desde la randomización hasta la aparición de metástasis. Por otro lado, en el estudio PROSPER16 se definió desde la randomización hasta la aparición de metástasis o recurrencia en la pelvis. Los objetivos secundarios fueron la supervivencia global, el tiempo al inicio de quimioterapia, el tiempo a la utilización de un nuevo tratamiento, calidad de vida, seguridad y tiempo a la progresión del PSA (ver Cuadro 2).
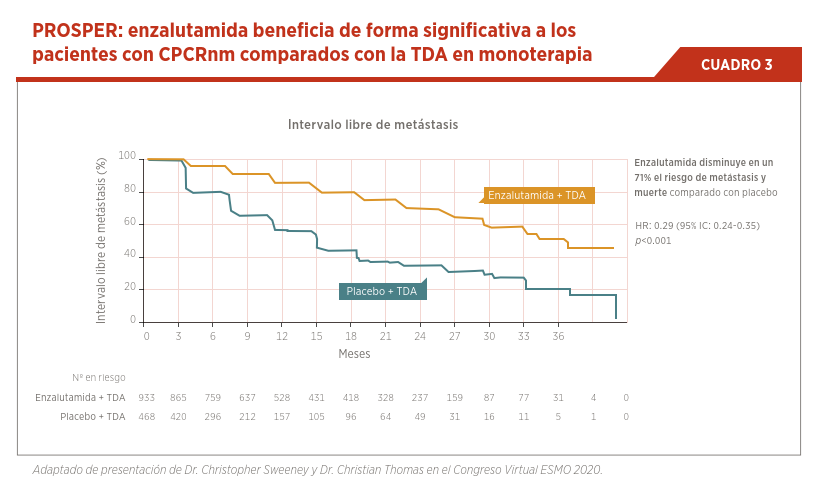
La intensificación del tratamiento de forma temprana en estos pacientes ha demostrado tener un impacto significativo en retrasar la aparición de metástasis en más de 2 años, así como en otros objetivos secundarios como la supervivencia global (ver Cuadro 3).
Este beneficio significativo se mantiene sin observar un deterioro en la calidad de vida con el tratamiento combinado. Los resultados de seguridad
de enzalutamida en estos pacientes no demostraron nuevos eventos tóxicos comparados con estudios pivotales del mismo tratamiento en otras situaciones de enfermedad, siendo fatiga, hot flashes y náuseas los eventos más frecuentemente reportados.
Esta evidencia demuestra que enzalutamida beneficia a los pacientes en las diferentes etapas de la enfermedad. El impacto del beneficio es mucho mayor con el tratamiento en etapas tempranas.
Referencias
1. Tannock IF, de Wit R, Berry WR, et al. Docetaxel plus Prednisone or Mitoxantrone plus Prednisone for Advanced Prostate Cancer. N Engl J Med. 2004;351(15):1502-1512. doi:10.1056/NEJMoa040720
2. Loriot Y, Fizazi K, de Bono JS, Forer D, Hirmand M, Scher HI. Enzalutamide in castration-resistant prostate cancer patients with visceral disease in the liver and/or lung: Outcomes from the randomized controlled phase 3 AFFIRM trial. Cancer. 2017;123(2):253-262. doi:10.1002/cncr.30336
3. Evans CP, Higano CS, Keane T, et al. The PREVAIL Study: Primary Outcomes by Site and Extent of Baseline Disease for Enzalutamide-treated Men with Chemotherapy-naïve Metastatic Castration-resistant Prostate Cancer. Eur Urol. 2016;70(4):675-683. doi:10.1016/j.eururo.2016.03.017
4. Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 2012;13(10):983-992. doi:10.1016/S1470-2045(12)70379-0
5. Ryan CJ, Smith MR, Fizazi K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 2015;16(2):152-160. doi:10.1016/S1470-2045(14)71205-7
6. Chi KN, Agarwal N, Bjartell A, et al. Apalutamide for Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med. 2019;381(1):13-24. doi:10.1056/NEJMoa1903307
7. Davis ID, Martin AJ, Stockler MR, et al. Enzalutamide with Standard First-Line Therapy in Metastatic Prostate Cancer. N Engl J Med. 2019;381(2):121-131. doi:10.1056/NEJMoa1903835
8. Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med. 2017;377(4):352-360. doi:10.1056/NEJMoa1704174
9. Sweeney CJ, Chen Y-H, Carducci M, et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. N Engl J Med. 2015;373(8):737-746. doi:10.1056/NEJMoa1503747
10. Armstrong AJ, Szmulewitz RZ, Petrylak DP, et al. ARCHES: A Randomized, Phase III Study of Androgen Deprivation Therapy With Enzalutamide or Placebo in Men With Metastatic Hormone-Sensitive Prostate Cancer. J Clin Oncol. 2019;37(32):2974-2986. doi:10.1200/JCO.19.00799
11. Smith MR, Saad F, Hussain M, et al. ARASENS: A phase 3 trial of darolutamide in combination with docetaxel for men with metastatic hormone-sensitive prostate cancer (mHSPC). J Clin Oncol. 2018;36(6_suppl):TPS383-TPS383. doi:10.1200/JCO.2018.36.6_suppl.TPS383
12. https://www.apccc.org/apccc2019.html. No Title.
13. Scher HI, Morris MJ, Stadler WM, et al. The Prostate Cancer Working Group 3 (PCWG3) consensus for trials in castration resistant prostate cancer (CRPC). J Clin Oncol. 2015;33(15_suppl):5000. doi:10.1200/jco.2015.33.15_suppl.5000
14. Fizazi K, Shore N, Tammela TL, et al. Nonmetastatic, Castration-Resistant Prostate Cancer and Survival with Darolutamide. N Engl J Med. 2020;383(11):1040-1049. doi:10.1056/NEJMoa2001342
15. Small EJ, Saad F, Chowdhury S, et al. Final survival results from SPARTAN, a phase III study of apalutamide (APA) versus placebo (PBO) in patients (pts) with nonmetastatic castrationresistant prostate cancer (nmCRPC). J Clin Oncol. 2020;38(15_suppl):5516. doi:10.1200/JCO.2020.38.15_suppl.5516
16. Hussain M, Fizazi K, Saad F, et al. Enzalutamide in Men with Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med. 2018;378(26):2465-2474. doi:10.1056/NEJMoa1800536




Lo sentimos, el formulario de comentarios está cerrado en este momento.