
Eficacia y seguridad de ABP-501 en pacientes con artritis reumatoidea: extensión abierta de un ensayo pivotal Fase 3
Dr. Stanley Cohen, Dr. José L. Pablos, Dr. Karel Pavelka, Dr. Gerard Anton Müller, Dr. Alan Matsumoto, Dr. Alan Kivitz, Dr. Hui Wang y Eswar Krishnan
Internal Medicine, Rheumatology Division, Metroplex Clinical Research Center, 8144 Walnut Hill Lane, Suite 800, Dallas, TX 75231, EE.UU., Instituto de Investigación Hospital 12 de Octubre, Madrid, España, Institute of Rheumatology, Praga 2, República Checa, Abteilung.für Nephrologie und Rheumatologie, Göttingen, Alemania, Arthritis and Rheumatism Associates, Wheaton, MD, EE.UU., Abteilung für Nephrologie und Rheumatologie, Göttingen, Alemania, Biosimilars Development, Amgen Inc., Thousand Oaks, CA, EE.UU
La artritis reumatoidea (AR) es una enfermedad inflamatoria sistémica crónica, caracterizada por la inflamación articular inmunomediada que puede llevar a la destrucción articular con aparición de secuelas y eventualmente discapacidad. La presencia de inflamación sistémica hace que además se produzca un aumento del riesgo cardiovascular, neoplásico y de osteoporosis en los pacientes afectados, por lo que su control es importante no solamente desde una perspectiva articular [1].
El uso temprano de medicaciones inmunosupresoras, el ahorro de esteroides y la implementación de estrategias basadas en objetivos con ajuste periódico de medicación han llevado a mejores resultados en estos pacientes y la aparición a fines de la última década del siglo pasado de las medicaciones biológicas ha permitido resultados inéditos con las terapias clásicas hasta ese momento [2].
Los biosimilares son medicamentos biológicos similares a un producto biológico ya licenciado y por sus características farmacológicas específicas como medicamentos proteicos (gran tamaño, estructura tridimensional y perfil de modificaciones postraslacional) no son exactamente iguales a sus productos de referencia y requieren programas de desarrollo con características especiales para demostrar equivalencia [3].
ABP-501 es el primer biosimilar de adalimumab aprobado por la FDA que demostró equivalencia en términos analíticos y en términos clínicos en dos ensayos de equivalencia de Fase 3, uno en pacientes con psoriasis cutánea y el otro en pacientes con artritis reumatoidea. Sucintamente, NCT01970475 fue un ensayo multicéntrico internacional a 26 semanas que evaluó la equivalencia de ABP-501 respecto del adalimumab original en pacientes con artritis reumatoidea con respuesta insuficiente a metotrexato, que incluyó 526 pacientes y los aleatorizó a ABP-501 o adalimumab original demostrando equivalencia clínica entre ambas intervenciones [4]. No obstante, 6 meses es un tiempo corto para establecer seguridad y eficacia, por lo que los estudios de extensión son un complemento importante de los ensayos clínicos aleatorizados. Se presentan a continuación los resultados de la extensión de NCT01970475 a 2 años [5].
Al concluir el ensayo aleatorizado, los pacientes incluidos en ambas ramas de tratamiento fueron invitados a participar en el estudio de extensión, recibiendo todos ABP-501. Fueron excluidos los pacientes que hubiesen presentado eventos adversos en el ensayo aleatorizado que se considerasen potencialmente riesgosos para la extensión a largo plazo, pacientes que hubiesen presentado infecciones con requerimiento de uso de antibióticos y pacientes con alteraciones de laboratorio significativas al final del estudio aleatorizado y pacientes que hubiesen desarrollado comorbilidades significativas. Todos los pacientes continuaron con su dosis estable de metotrexato y podían recibir esteroides hasta ≤10 mg/día de prednisona o equivalente. Los objetivos primarios del presente estudio fueron de seguridad, incluyendo incidencia de eventos adversos relacionados al tratamiento, eventos adversos serios, alteraciones de laboratorio e incidencia de anticuerpos antidroga.
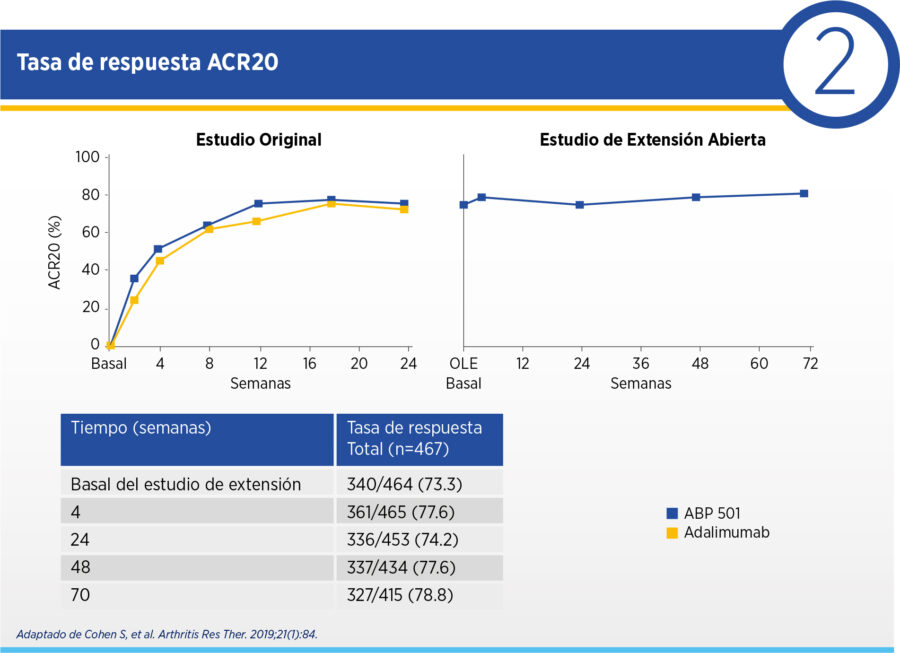
Los objetivos secundarios incluyeron respuesta ACR20 y ΔDAS28PCR entre basal del ensayo original y de la extensión y las semanas 4, 24, 48 y 70 de la extensión. De los 494 pacientes que completaron la fase aleatorizada del estudio, 467 fueron enrolados en la extensión y 466 recibieron al menos una dosis de ABP-501. 88.2% completaron el estudio de extensión.
De forma global, 63.7% de los pacientes presentaron al menos un evento adverso asociado a tratamiento durante la extensión, sin diferencias entre aquellos que recibieron siempre ABP-501 (62.4%) y aquellos que transicionaron desde adalimumab original (65%). Se registraron 59 eventos adversos serios en 46 pacientes, nuevamente con distribución similar entre pacientes que mantuvieron ABP-501 (25 pacientes) y aquellos que transicionaron desde el original (21 pacientes). No se reportaron eventos adversos fatales, enfermedades desmilienizantes, tuberculosis activa ni síndrome lupus-like durante el presente estudio (ver Cuadro 1).
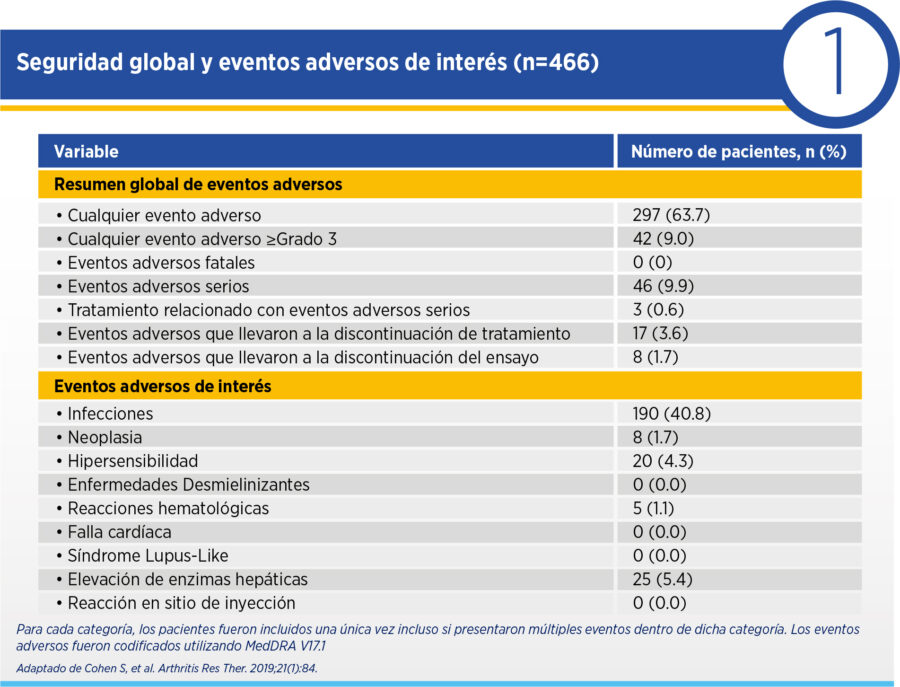
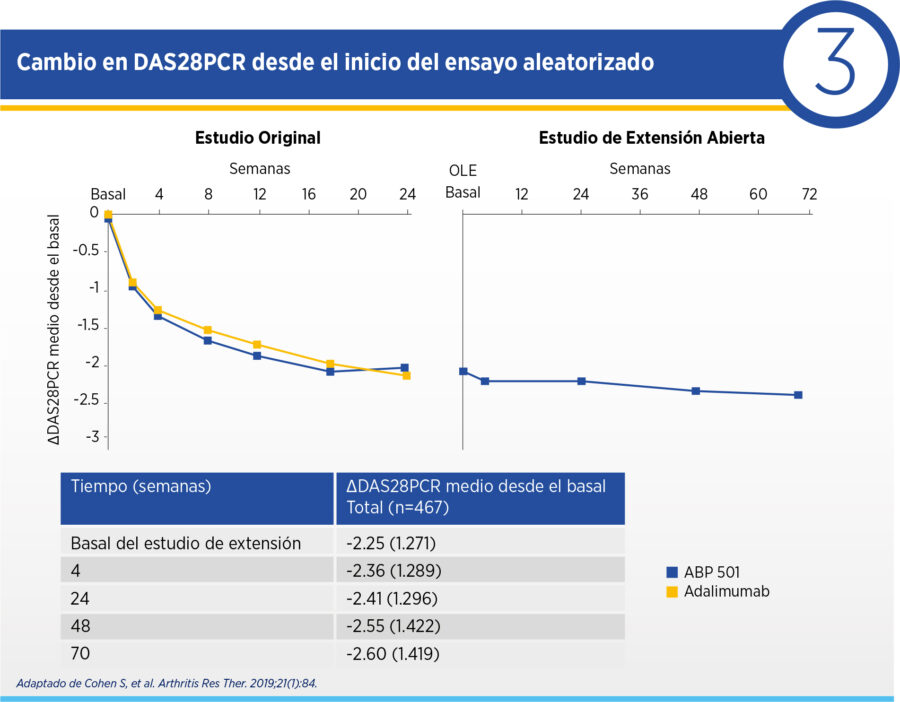
En términos de eficacia, al inicio de la fase de extensión el ΔDAS28PCR medio fue de -2.25 respecto del inicio del ensayo aleatorizado. Esta mejoría se sostuvo durante la extensión, con ΔDAS28PCR medio de -2.36 en semana 4, -2.41 en semana 24, -2.55 en semana 48 y -2.60 en semana 70 de la extensión. La frecuencia de remisión por DAS28PCR y de respuesta ACR20 se mantuvo estable desde el final de la fase aleatorizada durante toda la extensión (ver Cuadros 2 y 3).
Así, ABP-501 mostró equivalencia con el adalimumab original en términos analíticos y clínicos, tanto en ensayos aleatorizados como a largo plazo, lo que lo vuelve una herramienta valiosa dentro de las alternativas terapéuticas disponibles para el manejo de enfermedades inflamatorias crónicas, ampliando el acceso por parte de los pacientes a tratamientos biológicos de alta efectividad [6].
Referencias:
1. Smolen J, et al. Nature Reviews Disease Primers. 2018:18001. doi:10.1038/nrdp.2018.1
2. Curtis JR, et al. Clin Ther. 2011;33(6):679-707
3. Isaacs J, et al. Considerations in Medicine 2017;1:doi: 10.1136/conmed-2017-100003
4. Cohen S, et al. Ann Rheum Dis. 2017;76(10):1679-1687
5. Cohen S, et al. Arthritis Res Ther. 2019;21(1):84.
6. Pelechas E, et al. Expert Opin Biol Ther. 2018;18(3):317-322
Resumen elaborado por el staff de Circle Press.




Lo sentimos, el formulario de comentarios está cerrado en este momento.