
Equivalencia ABP-501 respecto de Adalimumab originador en artritis reumatoidea: resultados de un ensayo pivotal Fase 3
Dr. Stanley Cohen, Dr. Mark C Genovese, Dr. Ernest Choy, Dr. Fernando Perez-Ruiz, Dr. Alan Matsumoto, Dr. Karel Pavelka, Dr. José L Pablos, Dr. Warren Rizzo, Dr. Pawel Hrycaj, Dr. Nan Zhang, Dr. William Shergy, Dr. Primal Kaur
Metroplex Clinical Research Center, Dallas, Texas, EE.UU., Stanford University School of Medicine, Palo Alto, California, EE.UU., CREATE Centre, Section of Rheumatology, Institute of Infection and Immunity, Cardiff University, Cardiff, Reino Unido, Rheumatology Division, Cruces University Hospital, OSI EE-Cruces and Biocruces Health Research Institute, Vizcaya, España, Arthritis and Rheumatism Associates, Wheaton, Maryland, EE.UU., Na Slupi 4 Praha 2, Praha, República Checa, Instituto de Investigación Hospital 12 de Octubre, Universidad Complutense de Madrid, Madrid, España, Advanced Arthritis Care & Research, Scottsdale, Arizona, EE.UU., Department of Rheumatology and Clinical Immunology, Pozna? University of Medical Sciences, Pozna?, Polonia, Amgen Inc., Thousand Oaks, California, EE.UU., RANA Clinical Research Center, Huntsville, Alabama, EE.UU.
La artritis reumatoidea (AR) es una enfermedad inflamatoria crónica inmunomediada, caracterizada por la inflamación articular que puede llevar a la discapacidad. Se asocia además al aumento de riesgo cardiovascular, neoplásico y de osteoporosis [1].
El advenimiento de mejores estrategias de tratamiento, el uso temprano de medicaciones inmunosupresoras y el ahorro de esteroides han llevado a mejores resultados en estos pacientes, pero sin duda la aparición a fines de la última década del siglo pasado de las medicaciones biológicas ha marcado un hito en el manejo de esta patología crónica [2].
Los biosimilares son medicamentos biológicos similares a un producto biológico ya licenciado y son el equivalente a los “genéricos” para los medicamentos de síntesis química. Existen en el mercado numerosos biosimilares, no solo para medicamentos inmunosupresores u oncológicos, sino también para hormonas peptídicas o factores de crecimiento, lo cual ha aumentado el acceso de los pacientes a este tipo de medicaciones [3].
Debido a la complejidad de estas moléculas respecto de los medicamentos de síntesis química por su gran tamaño, estructura tridimensional y perfil de modificaciones postraslacional de las proteínas sintetizadas en distintos sustratos celulares, los biosimilares no son exactamente iguales a sus productos de referencia pero deben demostrar una alta similaridad, no solamente en términos analíticos de laboratorio sino también de pureza, potencia y seguridad. Por eso, los programas de desarrollo de los biosimilares difieren de los de los medicamentos originadores, ya que tienen un extenso estudio en términos analíticos y requieren menos estudios clínicos de Fase 3, que además tienen un diseño específico para este tipo de moléculas: los ensayos de equivalencia. En este tipo de ensayos, el producto biosimilar se compara contra el producto de referencia buscando demostrar que no existen diferencias significativas entre ambos [4].
ABP-501 es el primer biosimilar de adalimumab aprobado por la FDA, que demostró equivalencia en términos analíticos y en términos clínicos en dos ensayos de equivalencia de Fase 3, uno en pacientes con psoriasis cutánea y el otro en pacientes con artritis reumatoidea.
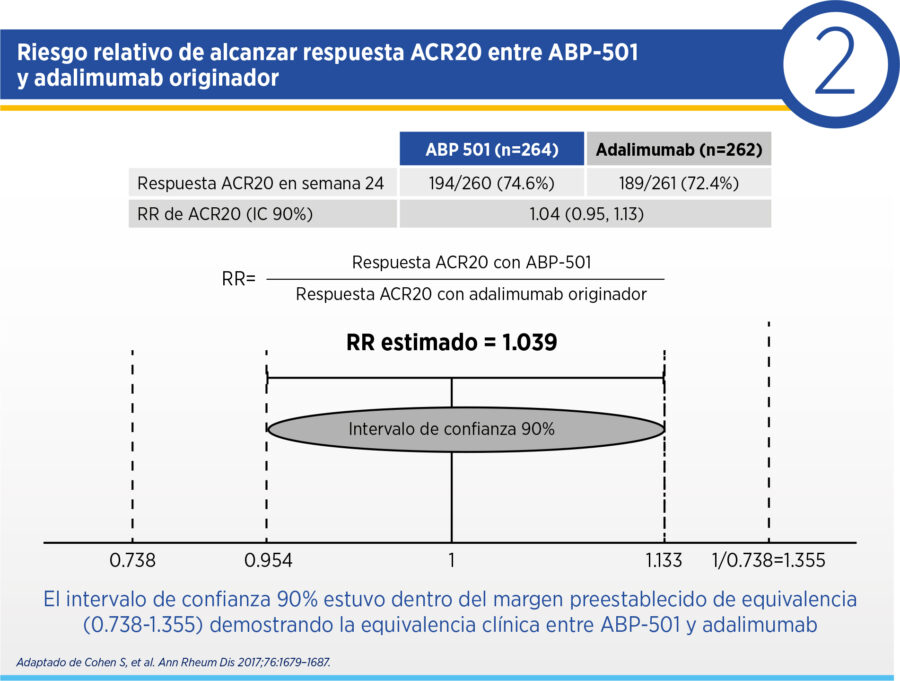
El ensayo NCT01970475 fue un ensayo multicéntrico internacional que evaluó la equivalencia de ABP-501 respecto del adalimumab original en pacientes con artritis reumatoidea que hubiesen presentado respuesta insuficiente a metotrexato [5] . Incluyó pacientes con diagnóstico de artritis reumatoidea que cumpliesen criterios ACR/EULAR 2010, con al menos 6 articulaciones inflamadas y 6 articulaciones dolorosas, VSG ≥28 mm/hora y/o PCR ≥1.0 mg/dL y seropositivos para factor reumatoideo (FR) y/o anticuerpos contra péptidos citrulinados (antiCCP). Los pacientes eran excluidos si habían recibido previamente ≥2 medicamentos biológicos previos para AR o si habían recibido adalimumab o un biosimilar del mismo. La hipótesis del ensayo fue que no existían diferencias significativas entre ambas intervenciones, por lo que el objetivo primario del ensayo fue el riesgo relativo (RR) de alcanzar ACR20 en semana 24, con un margen de equivalencia definido entre 0.738 y 1.355 (basado en guías FDA para ensayos clínicos de no inferioridad). Los objetivos secundarios de eficacia incluyeron ΔDAS28PCR, el riesgo relativo de alcanzar respuestas ACR20, ACR50 y ACR70 en distintos puntos temporales y la diferencia de riesgo en alcanzar estas respuestas. Se incluyeron 526 pacientes que fueron aleatorizados 1:1 a ABP-501 y adalimumab original. Las características basales de la población no mostraron diferencias y el uso de esteroides, antiinflamatorios y metotrexato fueron similares en ambas ramas. La mayoría de los pacientes incluidos (>70%) eran vírgenes de tratamientos biológicos.
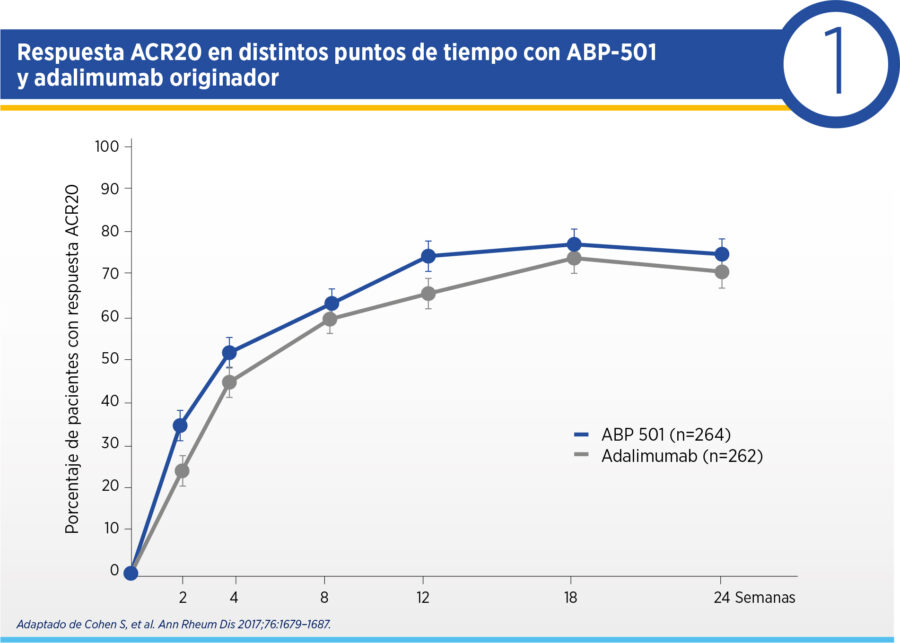
En la semana 24, 74.6% de los pacientes recibiendo ABP-501 y 72.4% de los pacientes en adalimumab original alcanzaron respuesta ACR20, con un RR 1.039 (IC 90% 0.954, 1.133) (ver Cuadro 1). El intervalo de confianza del RR se encontró dentro del margen establecido de equivalencia, demostrando la equivalencia clínica de ambos productos (ver Cuadro 2). Las respuestas ACR20, ACR50 y ACR70 en semana 2 y semana 8 también fueron similares en ambas intervenciones, al igual que el ΔDAS28PCR que fue -2.32 para ambos grupos con una diferencia de 0.01 y un intervalo de confianza 90% de -0.18-0.17, reforzando la equivalencia clínica de ambas intervenciones. En la semana 24, 30.5% de los pacientes recibiendo ABP-501 y 35.5% de los pacientes con adalimumab original se hallaban en remisión definida por DAS28PCR.
De forma global, 52.3% de los pacientes presentaron al menos un evento adverso emergente del tratamiento, con frecuencias similares entre ABP-501 y el adalimumab original (50.0% y 54.6% respectivamente), siendo los más frecuentes nasofaringitis, cefalea, artralgias, tos e infección del tracto respiratorio superior. El 4.4% de los pacientes presentó eventos adversos serios, nuevamente con una frecuencia similar entre ambos grupos (3.8% para ABP-501 y 5.0% para adalimumab original). No se reportaron casos de tuberculosis activa y la frecuencia de reacciones en el sitio de inyección fue similarmente baja en ambas intervenciones. La aparición de anticuerpos antidroga fue similar en ambos tratamientos. Habiendo demostrado alta similaridad en estudios analíticos y teniendo equivalencia clínica en dos ensayos clínicos de Fase 3 en dos indicaciones distintas (AR y psoriasis cutánea), ABP-501 alcanzó la totalidad de evidencia necesaria para ser aprobado como un biosimilar tanto por la agencia norteamericana FDA como por la europea EMA, entrando al arsenal terapéutico disponible para el manejo de enfermedades inflamatorias crónicas y ampliando la posibilidad de acceso a tratamientos biológicos de alta efectividad por parte de los pacientes [6].
Referencias:
1- Smolen J, et al. Nature Reviews Disease Primers. 2018:18001. doi:10.1038/nrdp.2018.1
2- Curtis JR, et al. Clin Ther. 2011;33(6):679-707
3- Smolen J, et al. RMD Open 2019;5:e000900. doi: 10.1136/rmdopen-2019-000900
4- Isaacs J, et al. Considerations in Medicine 2017;1:doi: 10.1136/conmed-2017-100003
5- Cohen S, et al. Ann Rheum Dis. 2017;76(10):1679-1687
6 Pelechas E, et al. Expert Opin Biol Ther. 2018;18(3):317-322
Resumen elaborado por el staff de Circle Press.




Lo sentimos, el formulario de comentarios está cerrado en este momento.