
Equivalencia de ABP-501 respecto de adalimumab originador en pacientes con psoriasis luego del intercambio: resultados de un ensayo pivotal Fase 3
Dr. K. Papp, Dr. H. Bachelez, Dr. A. Costanzo, Dr. P. Foley, Dr. M. Gooderham, Dr. P. Kaur, Dr. S. Philipp, Dr. L. Spelman, Dr. N. Zhang y Dr. B. Strober
Clinical Research, Waterloo, ON, Canadá, Probity Medical Research, Waterloo, ON, Canadá, Sorbonne Paris Cité Université Paris Diderot, Department of Dermatology, AP-HP HP Hospital Saint-Louis, INSERM U1163, Institut Imagine, París, Francia, Dermatology Unit, Department of Biomedical Sciences, Humanitas University, Rozzano – Milán, Italia, Department of Medicine (Dermatology), The University of Melbourne, St Vincent’s Hospital Melbourne, Australia, Skin & Cancer Foundation Inc., Carlton, Australia, Probity Medical Research, Carlton, Australia, SKiN Centre for Dermatology, ON, Canadá, Amgen Inc., Thousand Oaks, CA, EE.UU., Psoriasis Research and Treatment Center, University Hospital Charite, Berlín, Alemania, Veracity Clinical Research, Woolloongabba, Queensland, Australia, Probity Medical Research, Woolloongabba, Queensland, Australia, University of Connecticut Health Center, Farmington, CT, EE.UU., Probity Medical Research, Farmington, CT, EE.UU.
La psoriasis (PsO) es enfermedad inflamatoria crónica inmunomediada, caracterizada por la inflamación de la piel pero que puede tener múltiples manifestaciones extracutáneas, incluyendo compromiso musculoesquelético, oftamológico e intestinal y se asocia además al aumento de riesgo cardiovascular, insulinoresistencia, síndrome metabólico, mayor riesgo neoplásico, depresión y osteoporosis, siendo una verdadera enfermedad multidimensional [1] [2].
La aparición de tratamientos biológicos revolucionó el manejo de la psoriasis, permitiendo que los pacientes alcancen un control de enfermedad mucho mayor que el que permitían los tratamientos convencionales disponibles antes de la aparición de estas medicaciones, alcanzando frecuentemente remisión de la enfermedad, tanto a nivel de las manifestaciones cutáneas como de las manifestaciones extracutáneas asociadas a la enfermedad psoriásica [3]. Entre estas medicaciones, los inhibidores de TNF-a siguen siendo una valiosa herramienta terapéutica.
Los biosimilares son medicamentos biológicos similares a un producto biológico ya licenciado, algo afín al concepto de “genéricos” para los medicamentos de síntesis química. No obstante, debido a la complejidad de estas moléculas respecto de los medicamentos de síntesis química por su gran tamaño, estructura tridimensional compleja y perfil de modificaciones postraslacional por los distintos sustratos celulares utilizados para su síntesis, los biosimilares no son exactamente iguales a sus productos de referencia sino que deben demostrar una alta similaridad. Esta similaridad debe darse no solamente en términos analíticos de laboratorio sino también en cuanto a su eficacia clínica, su pureza y seguridad. Es por esta razón que los programas de desarrollo de medicamentos biosimilares no son exactamente iguales a los de los biológicos originadores, sino que se componen de un extenso estudio en términos analíticos y requieren estudios clínicos de Fase 3 con un diseño específico para demostrar equivalencia. En este tipo de ensayos, el producto biosimilar se compara contra el producto de referencia buscando demostrar que no existen diferencias significativas entre ambos [4]. Algunos trabajos incluso evalúan la posibilidad del impacto clínico del intercambio del biológico originador con un biosimilar.
ABP-501 es el primer biosimilar de adalimumab aprobado por la FDA, que demostró equivalencia en términos analíticos y en términos clínicos en dos ensayos de equivalencia de Fase 3, uno en pacientes con psoriasis cutánea, que incluyó intercambio de medicación, y el otro en pacientes con artritis reumatoidea.
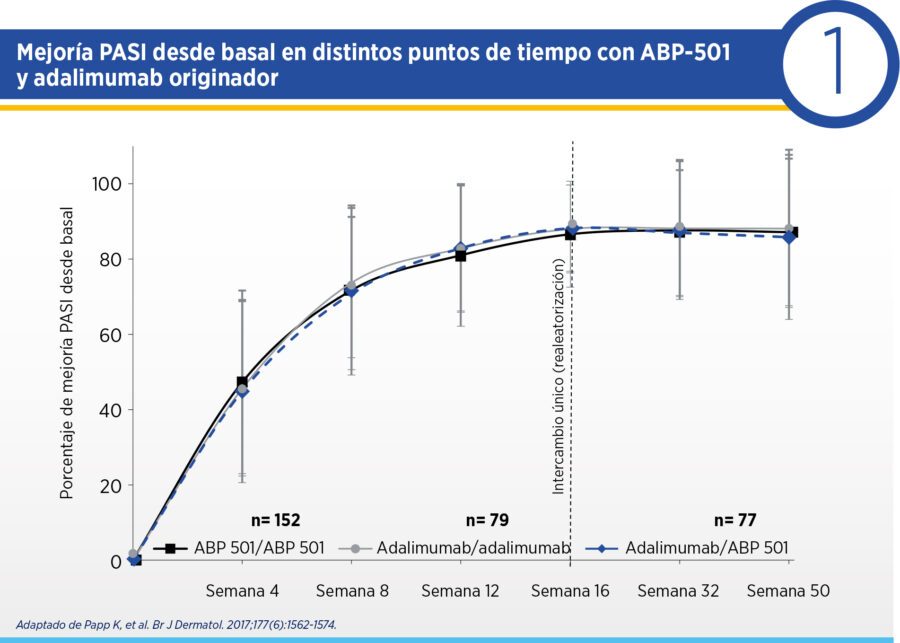
El ensayo NCT01970488 fue un ensayo multicéntrico internacional que evaluó la equivalencia de ABP-501 respecto del adalimumab original en pacientes con psoriasis cutánea moderada-severa [5] . Este ensayo incluyó pacientes ≥18 años con psoriasis en placas moderada-severa de ≥6 meses de duración, que fuesen candidatos a terapia sistémica o fototerapia y que presentasen respuesta insuficiente o intolerancia a al menos un tratamiento sistémico convencional. Los pacientes debían presentar un área comprometida (BSA – body surface area por sus siglas en inglés) ≥10%, un PASI ≥12 y una valoración por el médico (sPGA – static Physician’s Global Assessment por sus siglas en inglés) de al menos moderada severidad. Se excluyeron pacientes que hubiesen recibido adalimumab (originador o biosimilar) o ≥2 tratamientos biológicos para su psoriasis. Los pacientes fueron aleatorizados 1:1 a recibir ABP-501 o adalimumab original (80 mg como carga y 40 mg cada 2 semanas a partir de entonces) durante 16 semanas y al cumplir este lapso, aquellos en la rama de adalimumab original con respuesta PASI50 fueron realeatorizados a continuar con el originador o rotar a ABP-501 hasta la semana 52.
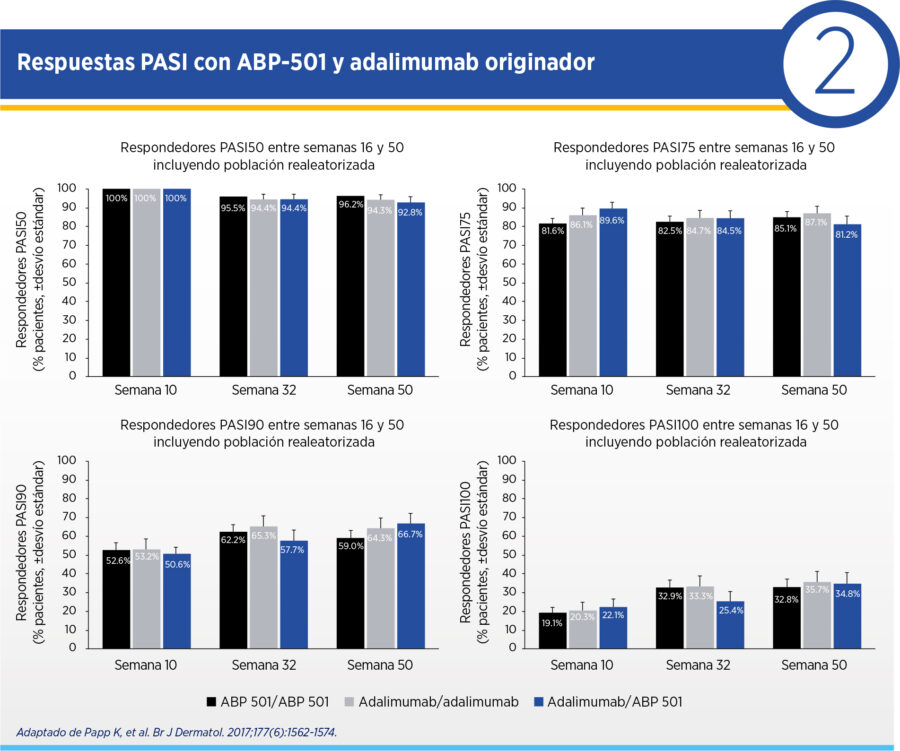
El objetivo primario de eficacia fue el porcentaje de mejoría PASI a semana 16 con un margen de equivalencia preespecificado de 15% en el intervalo de confianza 95% y los objetivos secundarios incluyeron PASI50, PASI75, PASI90, PASI100, sPGA a “limpio” (0) y “casi limpio” (1) y el cambio en BSA en semanas 16, 32 y 50.
Se incluyeron 350 pacientes. En la semana 16, el ΔPASI respecto del basal fue 80.9 para ABP-501 y 83.1 para adalimumab original (diferencia media 2.18, IC 95% 7.39-3.02), lo que demostró la equivalencia terapéutica de ambas intervenciones. Esta mejoría se sostuvo hasta la semana 50 en los pacientes que continuaron ABP-501, adalimumab original y aquellos que pasaron del originador a ABP-501 (ver Cuadro 1). Las respuestas PASI50, PASI75, PASI90 y PASI100 fueron similares a las semanas 16, 32 y 50 para los pacientes que continuaron tratamientos o que fueron realeatorizados de adalimumab original a ABP-501. El porcentaje de respondedores PASI90 y PASI100 aumentó entre la semana 16 y 50 (ver Cuadro 2). Así mismo, se objetivó similaridad en BSA y en sPGA en todos los puntos temporales para ambas intervenciones y en población que cambió entre el originador y ABP-501.
En términos de seguridad, no se encontraron diferencias entre el adalimumab original y ABP-501, ni en pacientes que continuaron cada terapéutica ni en aquellos que cambiaron del originador a ABP-501. Tampoco se encontraron diferencias en cuanto a la inmunogenicidad de los medicamentos en ninguno de los grupos evaluados.
Habiendo demostrado alta similaridad en estudios analíticos y teniendo equivalencia clínica en dos ensayos clínicos de Fase 3 en dos indicaciones distintas (AR y psoriasis cutánea), ABP-501 alcanzó la totalidad de evidencia necesaria para ser aprobado como un biosimilar tanto por la agencia norteamericana FDA como por la europea EMA, entrando al arsenal terapéutico disponible para el manejo de enfermedades inflamatorias crónicas y ampliando la posibilidad de acceso a tratamientos biológicos de alta efectividad por parte de los pacientes [6].
Referencias:
1. Armstrong AW, et al. JAMA. 2020;323(19):1945-1960
2. Rendon A, et al. Int J Mol Sci. 2019;20(6):1475.
3. Kamata M, et al. Int J Mol Sci. 2020;21(5):1690.
4. Isaacs J, et al. Considerations in Medicine 2017;1:doi: 10.1136/co med2017-100003
5. Papp K, et al. J Am Acad Dermatol. 2017;76(6):1093-1102
6. Papp K, et al. Br J Dermatol. 2017;177(6):1562-1574
Resumen elaborado por el staff de Circle Press.




Lo sentimos, el formulario de comentarios está cerrado en este momento.